Pengertian
Daftar isi
Sifat periodik unsur merupakan sifat unsur yang berhubungan dengan letak unsur dalam tabel periodik, Sifat periodik yang akan dibahas di sini ialah meliputi sifat atom yang berhubungan langsung dengan struktur atomnya, mencakup jari-jari atom, energi ionisasi, afinitas elektron dan juga keelektronegatifan. Sifat fisis yang meliputi kerapatan, titik leleh, titik didih dan juga daya hantar listrik tidak dibahas.
-
Jari-jari atom
Jari-jari atom merupakan jarak inti atom dan elekron terluar
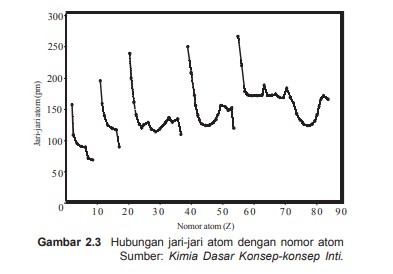
Kecenderungan jari-jari atom
- Dalam satu golongan jari-jaria atom dari atas ke bawah makin besar, karena jumlah kulit dari atas kebawah makin banuak walaupun muatan inti bertambah positif, maka gaya tarik inti terhadap elektron terluar makin lemah.
- Dalam satu periode jari-jari atom dari kiri ke kanan makin kecil, walaupun jumlah elektron dari kiri ke kanan bertambah tetapi masih menepati kulit yang sama. Bertambahnya muatan dalam inti menyebabkan gaya tarik inti terhadap elektron makin kuat, akibatnya jari-jari tom makin kecil.
-
Energi ionisasi
Energi ionisasi merupakan energi minimal yang dibutuhkan untuk melepaskan 1 elektron terluar dari atom berwujud gas pada keadaan dasarnya
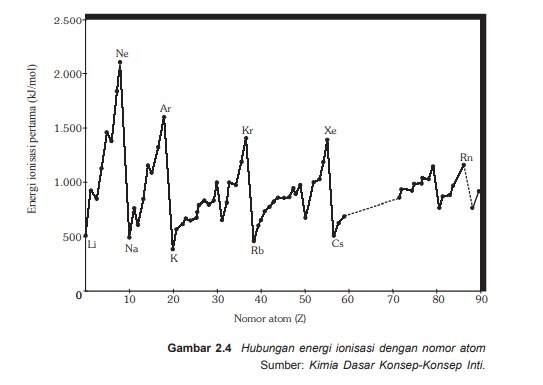
Kecnderungan energi ionisasi
- Dalam satu golongan energi ionisasi dari atas kebawah makin kecil, karena jari-jari atom bertambah besar. Walaupun jumlah muatan positif dalam inti bertambah tetapi gaya tarik inti terhadap elektron terluar makin lemah karena jari-jari makin panjang. Kaibatnya energi ionisasi makin berkurang
- Dalam satu periode energi ionisasi unusr dari kiri ke kanan makin besar, berambahnya jumlah muatan positif dalam inti dan juga jumlah kulit tetap mnyebabkan gaya tarik inti makin kuat, akibatnya energi iionisasi makin bertambah.
-
Efinitas elektron
Afinitas elektron merupakan energi yang terlibat ketika satu elektron diterima oleh satu unsur dalam keadaan gas
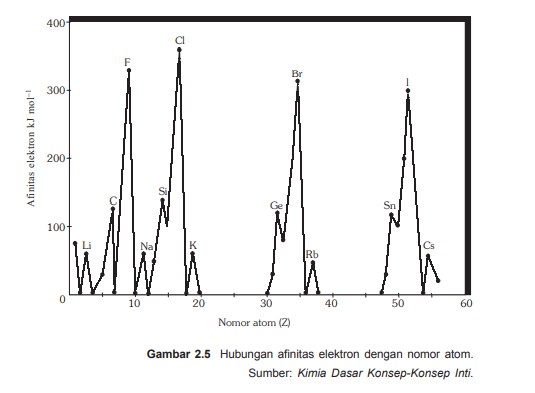
Afinitas elektron satu unsur
- Dalam satu golongan afinitas elektron unsur dari atas ke bawah makin berkurang, muattan inti berttambah posiif, jari-jari atom makin besar, dan gaya tarik inti terhadap elektron yang dilengkapi makin lemah, akibatnya afinitas elektron berkuranng
- Dalam satu periode afinitas elektron unsur dari kiri ke kanan cenderung bertambah, muatan inti bertambah positif sedangkan jumlah kulit tetap menyebabkan gaya tarik inti terhadap elektron yang ditangkan makin kuat, akibatnya afinitas elektron cenderung bertambah.
-
Keelektronegatifan
Kelektronegatifan merupakan kecenderungan atau kemampuan atom untuk menarik elektron dalam satu iktatan kimia, semakin besar keelektronegatifan suatu atom berarti dalam ikatan kimia atom tersebut cenderung menarik elektron dari atom yang lain. Sebagai contoh dalam iktana H dan CI, atom CI cenderung menarik elektron H, jari CI lebih elektronegatifan dai H, unsur-unsur golongna VIIIA sulit membentuk ikaan kimia atau tidak reaktif, jadi kelektronegatifannya sangat rendah

Keelektronegatifan suatu unsur:
- Dalam satu golongan keelektronigatifan unsur dari atas ke bawah makin berkurang, jumlah muatan inti bertambah positif jumlah kulit bertambah maka kemampuan inti untuk menarik elektron menjadi lemah, akibatnya keelektronegatifan unsur makin lemah.
- Dalam satu periode kelektronegatifan unsur dari kiri ke kanan cenderung naik, muatan inti bertambah positif jumlah kulit tetap, menyebabkan gaya tarik inti terhadap elektron makin kuat, akibatnya kemampuan atom untuk menarik elektron makin besar.
-
Sifat logam
Unsur-unsur dalam sistem periodik dibagi menjadi unsur logam, semilogam, dan juga non logam. Ke logaman unur terkait dengan energi ionisasi dan afinitas elektron, unsur logam memiliki energi inoneisasi kecil sehingga mudah melepas elektron membentuk ion positif. Unsur nonlogam memiliki afinitas elektron besar sehingga mudah menarik elektron membentuk ion negatif,
Sifat unsur logam
- Dalam satu golongan logam unsur bertambah dari atas ke bawah, dari ata kebawah energi ionisasi unsur berkurang sehingga makin mudah melepas elektron, sifat logam bertambah. Demikitan nilai afinitas elektron makin berkurang sehingga makin sulit bagi unsur untuk menangkap elektron, sifat nonlogam berkurang.
- Dalam satu periode sifat logam berkurang dari kiri ke kanan, sehingga makin sulit bagi unsur untuk melepas elektron. Berarti sifat logam makin berkuran. Nilai afinitas elektron bertambah dari kiri ke kanan, maka sehingga makin mudah bagi unsur untuk menarik elektron, akibatnya sifat nonlogam makin berkurang. Kecenderungan ini tidak berlaku bagi unsur-unsur transisi.
Demikianlah artikel dari dosenpintar.com mengenai √ 5 Sifat Periodik Unsur Beserta Pengertiannya, semoga artikel ini bermanfaat bagi anda semuanya.
baca juga :
