Struktur atom
Daftar isi
Konsep atom pertama kali ditemukan oleh demo cristus. Atom berasal dari kata atmos (dalam bahasa yunani a= tidak dan tomos = dibagi). jadi jka digabungkan, atom ialah partikel yang sudah tidak dapat dibagi lagi.
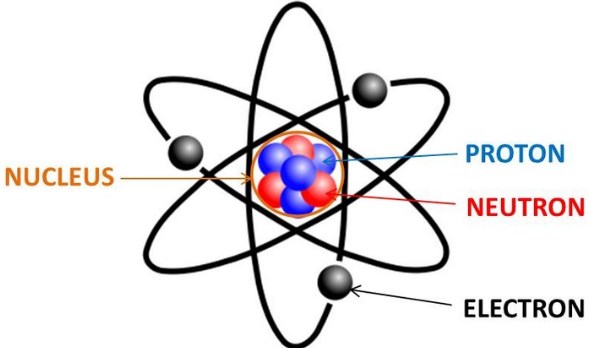
Menurut Dalton konsep atom democristus ini tidak bertentangan dengan hokum kekekalan massa dan hokum kekekalan energy. Sehingga Dalton membuat teori nya tentang atom yang salah satunya adalah materi tersusun atas partikel-partikel terkecil yang tidak dapat dibagi lagi.
Teori atom
Berikut ini kami akan menjelaskan mengenai perkembangan teori atom dati teori atom Dalton sampai teori atom bohr.
-
Teori atom Dalton
Berdasarkan pemikiran bahwa konsep atom democristus sesuai dengan hokum kekekalan massa dan hokum perbandingan tetap, maka john Dalton tahun 1803 merumuskan teori atom sebagai berikut.
- Materi tersusun atas partikel-partikel terkecil yang disebut atom
- Atom-atom penyusun unsur bersifat identic (sama dan sejenis)
- Atom suatu unsur yang tidak dapat diubah menjadi atom unsur lain
- Senyawa tersusun atas 2 jenis atom atau lebih dengan perbandingan tetap dan juga tertentu.
- Pada reaksi kimia terjadi penataulangan atom-atom yang bereaksi. Teaksi kimia terjadi karena pemisahan atom-atom senyawa untuk kemudian bergabung kembali membentuk senyawa baru.
Dalam perkembangannya tidak segala teori atom Dalton benar karena pada tahun 1897 J.J. Thomson menemukan partikel bermuatan listrik negative yang kemudian disebut electron. Tahun 1886 eugenen Goldstein menemukan partikel bermuatan listrik yang kemudian disebut proton. Dan tahun 1932 james chadwick berhasil menemukan neutron.
Salah satu hipotesis Dalton adalah reaksi kimia dapat terjadi karena penggabungan atom-atom atau pemisah gabungan atom. Misalnya logam natrium bersifat netral dan teaktif dengan air dan dapat menimbulkan ledakan. Jika logam natrium direaksikan dengan gas klorin yang bersifa racun dan berbau merangsang, maka akan dihasilkan NaCl yang tidak reaktif terhadap air, tidak beracun, dan tidak berbau merangsang seperti logam natrium dan gas klorin.
-
Teori atom Thomson
Setelah tahun 1897 joseph john Thomson berhasil membuktikan dengan tabung sinar katode bahwa sinar katode adalah berkas partikel yang bermuatan negarif yang ada pada setiap materi maka tahun 1898 J.J Thomson membuat suatu teori atom. Menurut Thomson, atom berbentuk bulat dimana muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh electron-elektron yang berbeda di antara muatan positif. Electron-elektron dalam atom diumpamakan seperti butiran kismis dalam roti, maka teori atom Thomson juga sering dikenal teori roti kismis.
-
Teori atom Rutherford
Pada tahun 1903 philipp Lenard melalui percobaannya membuktikan bahwa teori atom Thomson yang menyatakan bahwa elekron tersebar merata dalam muatan positif atom adalah tidak benar. Hal ini mendorong ernest Rutherford (1911) tertarik untuk melanjutkan eksperimen Lenard. Dengan bantuan kedua muridnya hans Geiger dan ernest mersden, Rutherford melakukan percobaan dengan hamburan sinar α. Partikel α bermuatan positif. Dari percobaan tersebut disumpulkan bahwa :
- Sebagian besar ruang dalam atom adalah tuang hampa ; partikel α diteruskan
- Didalam atom terdapat suatu bagian yang sangat kecil dan padat yang disebut inti atom; partikel α dipentulkan kembali oleh inti atom
- Muatan inti atom dan juga partikel α sejenis yaitu positif; sebagian kecil partikel α dibelokkan
Hasil percobaan tersebut menggugurkan teori atom Thomson. Kemudian Rutherford mengajukan teori atom sebagi berikut: atom tersusun atas inti atom yang bermuatan positif sebagai pusa massa dan keliling electron-elektron yang bermuatan negative.
-
Teori aton Bohr
Diawali dari pengamatan nels bohr terhadap spectrum atom, adanya spectrum garis menujukan bahwa electron hanya beredar pada lintasan-lintasan dengan energy tertentu. Dengan teori mekanikan kuantum planck, bohr (1913) menyampaikan 2 postulat untuk menjelaskan kestabilan atom.
Dua postulat bohr
- Electron mengelilingi inti atom ada lintasan tertentu yang stasioner yang disebut orbit/kulit. Wlaupun electron bergerak cepat tetapi elekton tidak memancarkan atau menyerap energy sehingga energy elekktron konstran. Hal ini berarti electron yang berputar mengelilingi inti atom memiliki lintasan tetap sehingga electron tidak jatuh ke inti.
- Electron dapat berpindah dari kulit yang satu ke kulit yang lain dengan memancarkan atau menyerap energy. Energy yang dipancarkan attau diserap ketika electron berpidah-pindah kulit desebut foton. Besarnya foton dirumuskan.
Energy yang dibawa foon inni bersifat diskrit (catu). Jika suatu atom menyrap energy, maka energy ini digunakan electron untk berpindah kulit dari tingkat energy rendah ke tingkat energy tinggi.
Kelemahan teori bohr
- Hanya mampu menjelaskan atom hydrogen tetapi tidak mampu menjelaskan spectrum atom yang lebih kompleks
- Orbit/kulit elekron mengelilingi inti atom bukan berbentuk lingkaran melainkan berbentk elips
- Bohr menganggap elekron hanya sebagai partikel bukan sebagai partikel dan gelombang, sehingga kedudukan elekron dalam atom merpakan kebolehanjadian
-
Teori aton mekanika kuantum
Konsep bor tentang tingkat-tingakt energy mendasari perkembangan teori atom mekanika kuantum. Electron terletak pada orbital-orbital. Orbital merupakan suatu ruangan dimana kebolehjadian ditemukannya electron.
demikianlah artikel dari dosenpintar.com megenai √5 Teori Atom : Dalton , Thomson , Rutherford , Bohr dan Mekanika Kuantum, semoga artikel ini bermanfaat bagi anda yang membacanya.
