Konfigurasi Elektron – Hello para pembaca dosenpintar.com, di pembahasan sebelumnya kita sudah membahas mengenai tabel periodik unsur kimi, maka kali ini kita akan membahas mengenai konfigurasi elektron. Yuk simak langsung mengenai artikel konfigurasi elektron di bawah ini.

Pengertian Konfigurasi Elektron
Daftar isi
Elektron melakukan orbit pada tingkatan energi tertentu, sementara Konfigurasi elektron adalah susunan penyebaran (pengisian) elektron-elektron dalam. Di dalam atom terdapat partikel subatomik neutron dan proton yang terdapat pada inti atom, dan elektron yang bergerak mengelilingi inti atom tersebut pada kulit-kulit elektron (level-level energi) yang tertentu.
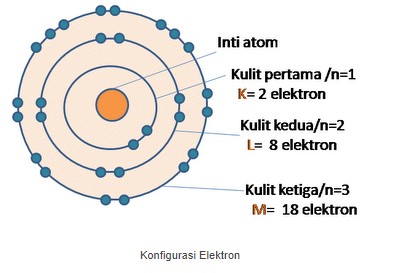
Jika nilai n dalam konfigurasi elektron semakin besar, maka bisa mengakibatkan kulit elektron semakin jauh dari inti atom serta energi elektron akan membesar pada kulit yang terkait. Menyebabkan elektron tersebut mengisi bagian kulit pada atom, berawal dari kulit K yang memiliki tingkat energi paling rendah. Namun kulit elektron hanya bisa diisi oleh beberapa jumlah elektron saja. Jumlah maksimal elektron yang yapat mengisi bagian kulit elektron ke n ialah 2n2, dan untuk jumlah maksimal pada bagian kulit elektron terluar dalam atom ialah 8.
Hal yang kamu harus ingat bahwa :
– Orbital s diisi 2 elektron
– Orbital p diisi 6 elektron
– Orbital d diisi 10 elektron
– Orbital f diisi 14 elektron
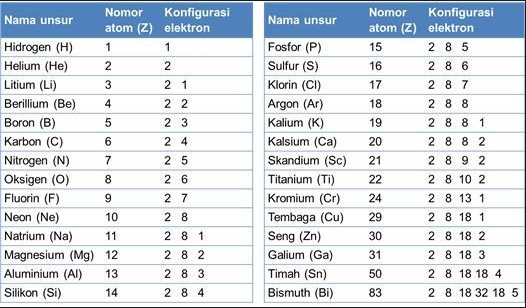
perhatikan gambar dibawah ini untuk lebih jelasnya.
Contoh Soal
Tentukan konfigurasi elektron dan jumlah elektron pada setiap kulit elektron atom Ni (Z = 28) dan Sr (Z = 38)!
Jawab :Ni (Z = 28) maka konfigurasinya adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d8 atau [Ar] 4s2 3d8 dan jumlah elektron pada setiap kulit adalah K berjumlah 2, L berjumlah 8, M berjumlah 16 dan N berjumlah 2Sr (Z = 38) maka konfigurasinya adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d8 5s2atau [Kr] 5s2dan jumlah elektron pada setiap kulit adalah K berjumlah 2, L berjumlah 8, M berjumlah 18, N berjumlah 2, dan O berjumlah 2.
Bilangan Kuantum
Bilangan kuantum atau disebut juga sebagai kulit atom, disimbolkan dengan simbol (n) dengan n=1, n=2, n=3, n=4, n=5, n=6, n=7. Namun untuk bilangan kuantum azimut atau disebut juga subkulit atom dapat disimbolkan dengan (l). Orbital nya akan diisi dengan jumlah maksimal 2 elektron yang mempunyai bilangan spin (s). Jenis dari bilangan kuantum tersbut berguna untuk mendiskripsikan energi dalam elektron. Berikut mengenai penjelasnya:
- Bilangan kuantun utama (n) dalam konfigurasi elektron menggambarkan tingkat dan ukuran dari energi orbital. Nilai n bisa memiliki bilangan bulat yang positif.
- Bilangan kuantum azimuth (l) dalam konfigurasi elektron menggambarkan bentuk orbitalnya. Nilai l bisa memiliki bilangan bulat mulai dari 0 sampai n-1.
- Bilangan kuantum magnetik (m) dalam konfigurasi elektron menggambarkan orientasi orbital. Nilai m bisa memiliki bilangan mulai dari -1 sampai +1.
- Bilangan kuantum spin (s) dalam konfigurasi elektron menggambarkan arah dari spin elektron orbital. Nilai s bisa memiliki bilangan +1/2 atau -1/2.
Aturan Dalam Konfigurasi Elektron
Untuk menentukan konfigurasi elektron tentu ada aturan-aturan yang harus di penuhi. Inilah beberapa aturan dalam penentuan konfigurasi elektron :
- Aturan Aufbau, dimana elektron harus berada dalam orbital dengan tingkat energi paling redah terlebih dahulu, dimulai dari 1s, 2s, 2p, dan sebagainya menurut urutan sub kulit.
- Aturan Pauli, dimana dua elektron tidak berada dalam satu atom yang mempunyai empat bilangan kuantun yang sama. Setiap orbital hanya dapat terisi dengan 2 elektron yang spinnya berlawanan.
- Aturan Hund, yaitu jika orbitalnya memiliki tingkat energi sama, maka konfigurasi elektronnya menggunakan energi yang paling rendah. Maka jumlah elektron yang tidak memiliki pasangan akan mempunyai spin pararel terbanyak.
Baca Juga :
